- Autor Alex Aldridge [email protected].
- Public 2023-12-17 13:49.
- Naposledy zmenené 2025-06-01 07:37.
Kľúčový rozdiel medzi reakciami prvého a druhého rádu je v tom, že rýchlosť reakcií prvého rádu závisí od prvej mocniny koncentrácie reaktantu v rýchlostnej rovnici, zatiaľ čo rýchlosť reakcií druhého rádu závisí od druhej mocniny koncentrácie výraz v sadzobnej rovnici.
Poriadok reakcie je súčet mocnín, na ktoré sa zvýšia koncentrácie reaktantov v rovnici rýchlosti. Podľa tejto definície existuje niekoľko foriem reakcií; reakcie nultého poriadku (tieto reakcie nezávisia od koncentrácie reaktantov), reakcie prvého poriadku a reakcie druhého poriadku.
Čo sú reakcie prvého rádu?
Reakcie prvého poriadku sú chemické reakcie, ktorých rýchlosť reakcie závisí od molárnej koncentrácie jedného z reaktantov, ktoré sa zúčastňujú reakcie. Preto podľa vyššie uvedenej definície poradia reakcií bude súčet mocnín, na ktoré sa zvýšia koncentrácie reaktantov v rovnici rýchlostného zákona, vždy 1. Môže existovať buď jeden reaktant, ktorý sa zúčastňuje týchto reakcií. Potom koncentrácia tohto reaktantu určuje rýchlosť reakcie. Ale niekedy sa týchto reakcií zúčastňuje viac ako jeden reaktant, potom jeden z týchto reaktantov určí rýchlosť reakcie.
Uvažujme o príklade, aby sme pochopili tento koncept. Pri rozkladnej reakcii N2O5 vzniká NO2 a O 2 plyny ako produkty. Keďže má iba jeden reaktant, môžeme reakciu a rýchlostnú rovnicu zapísať nasledovne.
2N2O5(g) → 4NO2(g) + O 2(g)
Sadzba=k[N2O5(g)]m
Tu k je rýchlostná konštanta pre túto reakciu a m je poradie reakcie. Preto z experimentálnych stanovení je hodnota m 1. Ide teda o reakciu prvého poriadku.
Čo sú reakcie druhého rádu?
Reakcie druhého rádu sú chemické reakcie, ktorých rýchlosť reakcie závisí od molárnej koncentrácie dvoch reaktantov alebo od druhej sily jedného reaktantu, ktorý sa podieľa na reakcii. Preto podľa vyššie uvedenej definície poradia reakcie bude súčet výkonov, na ktoré sa zvýšia koncentrácie reaktantov v rovnici rýchlostného zákona, vždy 2. Ak existujú dva reaktanty, rýchlosť reakcie bude závisieť od prvej mocniny. koncentrácie každého reaktantu.
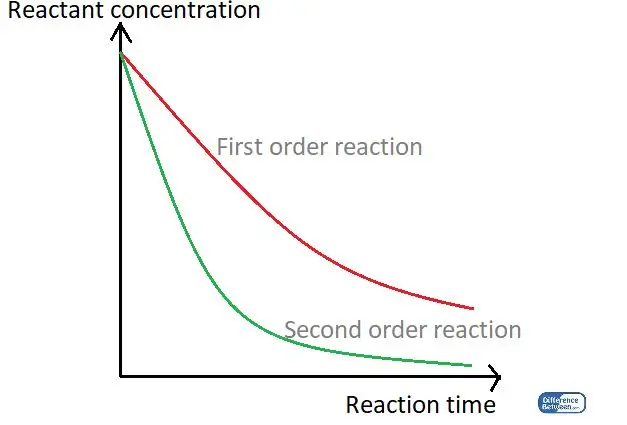
Obrázok 01: Graf porovnávajúci dva typy poradia reakcií pomocou ich reakčného času a koncentrácie reaktantov.
Ak zvýšime koncentráciu reaktantu 2-krát (ak sú v rýchlostnej rovnici dva reaktanty), potom sa rýchlosť reakcie zvýši 4-krát. Uvažujme napríklad o nasledujúcej reakcii.
2A → P
Tu A je reaktant a P je produkt. Potom, ak ide o reakciu druhého rádu, rovnica rýchlosti pre túto reakciu je nasledovná.
Sadzba=k[A]2
Ale pre reakciu s dvoma rôznymi reaktantmi, ako je nasledovné;
A + B → P
Sadzba=k[A]1[B]1
Aký je rozdiel medzi reakciami prvého a druhého rádu?
Reakcie prvého poriadku sú chemické reakcie, ktorých rýchlosť reakcie závisí od molárnej koncentrácie jedného z reaktantov, ktoré sa zúčastňujú reakcie. Preto, ak zvýšime koncentráciu reaktantu 2-krát, rýchlosť reakcie sa zvýši 2-krát. Reakcie druhého rádu sú chemické reakcie, ktorých rýchlosť reakcie závisí od molárnej koncentrácie dvoch reaktantov alebo od druhej sily jedného reaktantu, ktorý sa podieľa na reakcii. Ak teda zvýšime koncentráciu reaktantu 2-krát, rýchlosť reakcie sa zvýši 4-krát. Nižšie uvedená infografika predstavuje rozdiel medzi reakciami prvého a druhého rádu vo forme tabuľky.

Zhrnutie - reakcie prvého a druhého rádu
Existujú tri hlavné typy reakcií podľa poradia reakcie; reakcie nultého rádu, prvého a druhého rádu. Kľúčový rozdiel medzi reakciami prvého a druhého rádu je v tom, že rýchlosť reakcie prvého rádu závisí od prvej mocniny koncentrácie reaktantu v rýchlostnej rovnici, zatiaľ čo rýchlosť reakcie druhého rádu závisí od druhej mocniny koncentračného výrazu v rýchlostnej rovnici. sadzobná rovnica.






