- Autor Alex Aldridge [email protected].
- Public 2023-12-17 13:49.
- Naposledy zmenené 2025-06-01 07:37.
Kľúčový rozdiel medzi kyselinou uhličitou a hydrogénuhličitanom je v tom, že kyselina uhličitá je neutrálna chemická zlúčenina, zatiaľ čo hydrogénuhličitan je záporne nabitá chemická zlúčenina.
Kyselina uhličitá je slabá kyselina, ktorá sa tvorí v roztoku, keď sa oxid uhličitý rozpustí vo vode, s chemickým vzorcom H2CO3. Hydrogénuhličitan vzniká kombináciou troch atómov kyslíka, atómu vodíka a atómu uhlíka s chemickým vzorcom HCO3-.
Čo je kyselina uhličitá?
Kyselina uhličitá je H2CO3. Niekedy dávame tento názov roztokom s oxidom uhličitým rozpusteným vo vode alebo sýtenej vode. Sýtená voda totiž obsahuje malé množstvo H2CO3. Okrem toho je kyselina uhličitá slabá kyselina a môže tvoriť dva typy solí ako uhličitany a hydrogenuhličitany. Molárna hmotnosť tejto zlúčeniny je 62,024 g/mol.
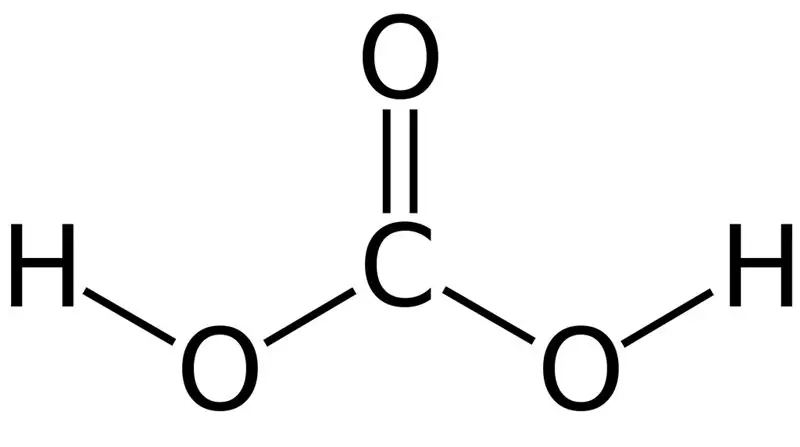
Obrázok 01: Chemická štruktúra kyseliny uhličitej
Keď sa oxid uhličitý rozpustí vo vode, dostane sa do rovnováhy medzi oxidom uhličitým a kyselinou uhličitou. Rovnováha je nasledovná:
CO2 + H2O ⟷ H2CO3
Ak k zásade pridáme nadbytok kyseliny uhličitej, získame hydrogénuhličitan. Ak je však nadbytok zásady, potom má kyselina uhličitá tendenciu vytvárať sýtené soli. Presnejšie povedané, kyselina uhličitá je zlúčenina karboxylovej kyseliny, ktorá má dva substituenty hydroxylovej skupiny pripojené na karbonylový uhlík. Navyše je to polyprotická kyselina, ktorá je schopná darovať protóny. Má dva odnímateľné protóny, takže je špecificky diprotický.
Čo je bikarbonát?
Bikarbonát vzniká kombináciou troch atómov kyslíka, atómu vodíka a atómu uhlíka. Produktom tejto kombinácie môže byť ión alebo zlúčenina s väčším počtom elektrónov ako protónov. Môžeme ho opísať ako chemický druh s chemickým vzorcom HCO3-.
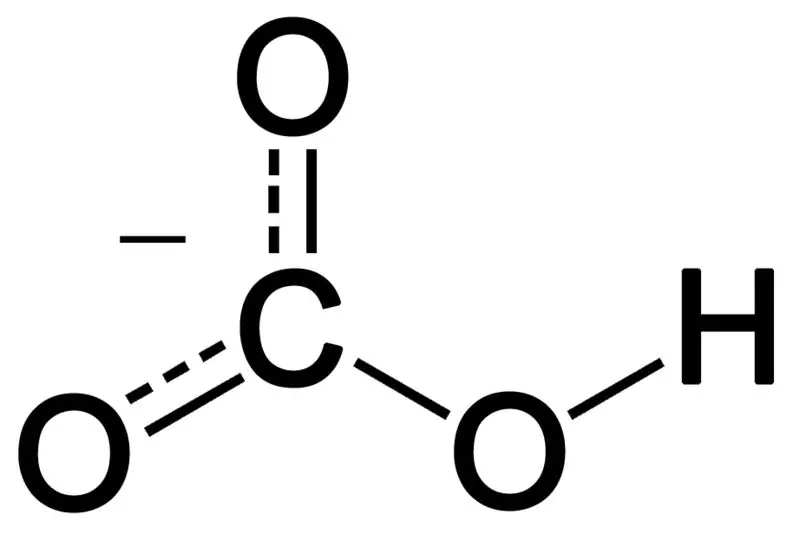
Obrázok 02: Chemická štruktúra hydrogénuhličitanového aniónu
Táto zlúčenina je laicky povedané kľúčovou súčasťou systému vyrovnávania pH tela: je zodpovedná za udržiavanie krvi v stave, ktorý nie je príliš kyslý ani príliš zásaditý. Okrem toho slúži ako spôsob, ako udržať tráviace šťavy pod kontrolou, keď žalúdok dokončí trávenie potravy. Okrem toho kyselina uhličitá v dažďovej vode vytvára bikarbonátové ióny, keď narazí na skaly. Tento tok hydrogénuhličitanových iónov je dôležitý pre udržanie uhlíkového cyklu v chode.
Aký je rozdiel medzi kyselinou uhličitou a bikarbonátom?
Kyselina uhličitá je slabá kyselina, ktorá sa tvorí v roztoku, keď sa oxid uhličitý rozpustí vo vode, a jej chemický vzorec je H2CO3. Hydrogénuhličitan vzniká kombináciou troch atómov kyslíka, atómu vodíka a atómu uhlíka s chemickým vzorcom HCO3-. Kľúčový rozdiel medzi kyselinou uhličitou a hydrogénuhličitanom je v tom, že kyselina uhličitá je neutrálna chemická zlúčenina, zatiaľ čo hydrogénuhličitan je záporne nabitá chemická zlúčenina. Okrem toho sa kyselina uhličitá používa pri výrobe bublinkových, šumivých nápojov, pri liečbe dermatitídy, v ústnej vode atď., zatiaľ čo hydrogénuhličitan sa používa v potravinových prípravkoch, ako je pečenie (ako kypriaci prostriedok), a dáva schopnosť odolávať zmenám pH.
Nasledujúca infografika sumarizuje rozdiel medzi kyselinou uhličitou a bikarbonátom v tabuľkovej forme na porovnanie vedľa seba.
Zhrnutie - Kyselina uhličitá verzus bikarbonát
Kyselina uhličitá je H2CO3. Hydrogénuhličitan vzniká kombináciou troch atómov kyslíka, atómu vodíka a atómu uhlíka, s chemickým vzorcom HCO3-. Kľúčový rozdiel medzi kyselinou uhličitou a hydrogénuhličitanom je v tom, že kyselina uhličitá je neutrálna chemická zlúčenina, zatiaľ čo hydrogénuhličitan je záporne nabitá chemická zlúčenina.






