- Autor Alex Aldridge aldridge@what-difference.com.
- Public 2023-12-17 13:49.
- Naposledy zmenené 2025-06-01 07:37.
Kľúčový rozdiel - alifatické a aromatické uhľovodíky
Najprv sa stručne pozrime, aké uhľovodíky rozoberajú rozdiel medzi alifatickými a aromatickými uhľovodíkmi. Uhľovodíky sú organické zlúčeniny obsahujúce vo svojej štruktúre atómy uhlíka a vodíka. Kľúčový rozdiel medzi alifatickými a aromatickými uhľovodíkmi je v tom, že alifatické uhľovodíky neobsahujú konjugovaný systém väzieb, zatiaľ čo aromatické uhľovodíky obsahujú systém konjugovaných väzieb. Obe tieto molekuly sa však považujú za organické zlúčeniny.
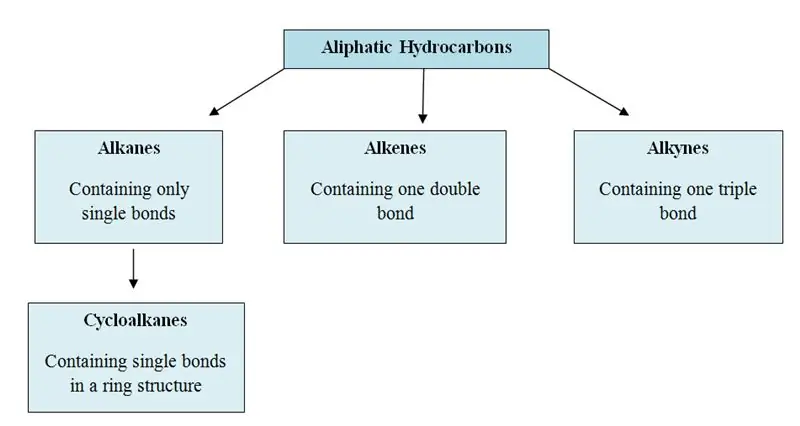
Čo sú alifatické uhľovodíky?
Alifatické uhľovodíky sú organické molekuly obsahujúce vo svojej štruktúre atómy uhlíka (C) a vodíka (H); v priamych reťazcoch, rozvetvených reťazcoch alebo nearomatických kruhoch. Alifatické uhľovodíky možno kategorizovať do troch hlavných skupín; alkány, alkény a alkíny.
Čo sú aromatické uhľovodíky?
Aromatické uhľovodíky sú niekedy známe ako „arény“alebo „arylové uhľovodíky“. Väčšina aromatických uhľovodíkov obsahuje vo svojej štruktúre benzénový kruh; existujú však nebenzénové aromatické uhľovodíky nazývané heteroarény, ktoré sa riadia „Huckleovým pravidlom“(cyklické kruhy, ktoré sa riadia Huckleovým pravidlom, majú počet π-elektrónov 4n+2; kde n=0, 1, 2, 3, 4, 5, 6). Niektoré aromatické uhľovodíky majú viac ako jeden kruh; nazývajú sa polycyklické aromatické uhľovodíky.
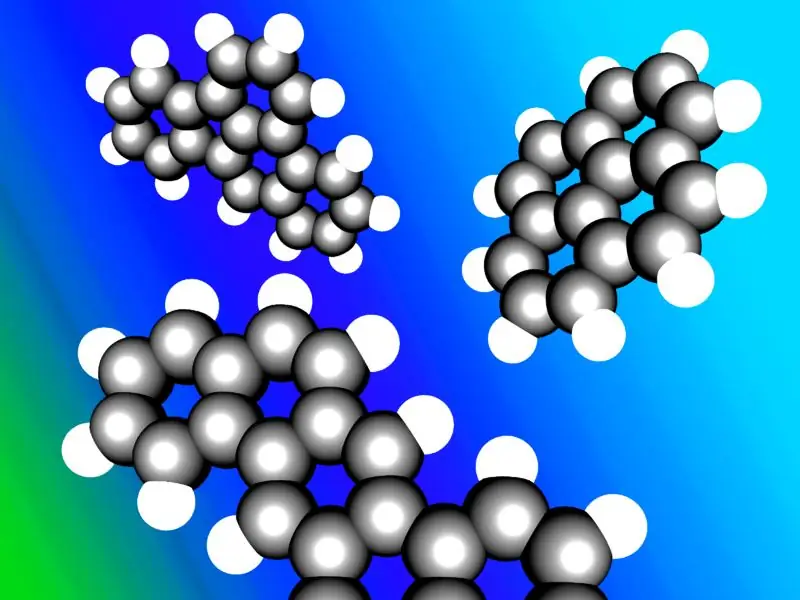
Ilustrácia typických polycyklických aromatických uhľovodíkov.
Aký je rozdiel medzi alifatickými a aromatickými uhľovodíkmi?
Štruktúra alifatických a aromatických uhľovodíkov
Alifatické uhľovodíky: Vo svojej štruktúre majú priame reťazce, rozvetvené reťazce alebo nearomatické kruhy. Táto skupina obsahuje nasýtené aj nenasýtené uhľovodíky. Alkány sú nasýtené uhľovodíky, alkény a alkíny sú nenasýtené uhľovodíky.
Rovné reťaze:
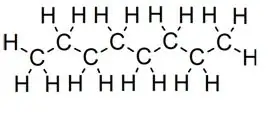
oktánové číslo
Značkové reťazce:
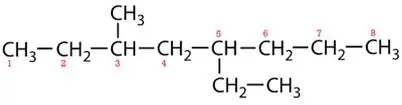
5-etyl-3-metyloktán

2-metyl-3-pentence
Nearomatické prstene:
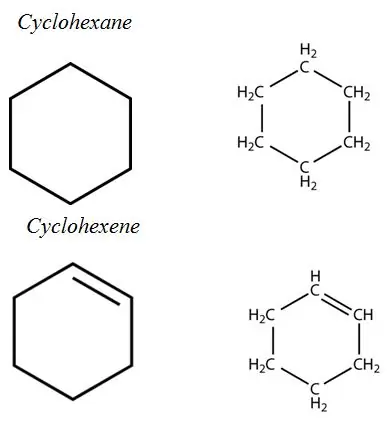
Aromatické uhľovodíky: Aromatické uhľovodíky majú vo svojej štruktúre aromatický kruhový systém. Všetky sú to nenasýtené uhľovodíky, ale relatívne stabilné vďaka systému konjugovaných väzieb.
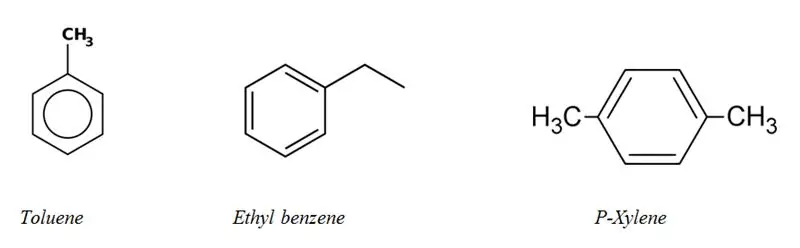
Kategórie alifatických a aromatických uhľovodíkov
Alifatické uhľovodíky:
Alifatické uhľovodíky majú tri hlavné skupiny; alkány, alkény a alkíny. Sú tiež známe ako alylové uhľovodíky.
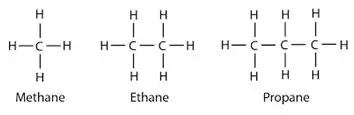
Alkány: V alkánoch sú atómy uhlíka a vodíka spojené jednoduchými väzbami. Nemajú viacnásobné väzby. Alkány tvoria kruhové štruktúry, nazývajú sa cykloalkány.
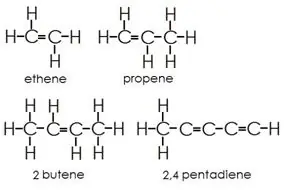
Alkény: Táto skupina obsahuje jednoduché aj dvojité väzby medzi atómami uhlíka. Atómy vodíka a uhlíka vždy tvoria jednoduché väzby.
Alkíny: Alkíny majú okrem jednoduchých väzieb aj trojité väzby medzi atómami uhlíka.
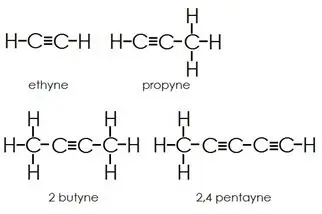
Aromatické uhľovodíky:
Väčšina aromatických uhľovodíkov obsahuje vo svojej štruktúre aspoň jeden benzénový kruh. Existuje však málo nebenzénových aromatických uhľovodíkov, nazývajú sa „heteroarény“. Aromatické uhľovodíky sa nazývajú „arylové“uhľovodíky.
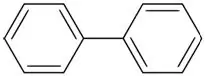
Bifenyl (aromatický uhľovodík s dvoma benzénovými kruhmi)
Vazba alifatických a aromatických uhľovodíkov
Alifatické uhľovodíky:
V alifatických uhľovodíkoch; jednoduché, dvojité alebo trojité väzby môžu existovať kdekoľvek v molekule. Niekedy môže existovať niekoľko štruktúr pre jeden molekulový vzorec zmenou polohy viacnásobnej väzby (väzieb). Tieto molekuly majú lokalizovaný elektrónový systém.
Aromatické uhľovodíky:
V aromatických uhľovodíkoch majú alternatívny systém jednoduchých a dvojitých väzieb na vytvorenie systému konjugovaných väzieb na delokalizáciu niektorých elektrónov. (Delokalizované elektróny sa môžu presúvať z jednej väzby na druhú).
Reakcie alifatických a aromatických uhľovodíkov
Alifatické uhľovodíky:
Nasýtené uhľovodíky podliehajú substitučným reakciám; nenasýtené uhľovodíky dosahujú stabilitu adičnou reakciou. Niektoré reakcie však prebiehajú za kontrolovaných podmienok bez prerušenia viacerých väzieb.
Aromatické uhľovodíky:
Aromatické uhľovodíky sú nenasýtené, ale majú stabilný konjugovaný elektrónový systém, takže sú náchylnejšie na substitučné reakcie než na adičné reakcie.
Obrázok s láskavým dovolením: „Polycyklické aromatické uhľovodíky“od Inductiveload - vlastná práca nahrávača, Accelrys DS Visualizer. (Verejná doména) cez Commons






