- Autor Alex Aldridge [email protected].
- Public 2023-12-17 13:49.
- Naposledy zmenené 2025-06-01 07:37.
Kľúčový rozdiel - metán vs etán
Metán a etán sú najmenší členovia rodiny alkánov. Molekulové vzorce týchto dvoch organických zlúčenín sú CH4 a C2H6. kľúčový rozdiel medzi metánom a etánom je ich chemická štruktúra; molekulu etánu možno považovať za dve metylové skupiny spojené ako dimér metylových skupín. Ostatné chemické a fyzikálne rozdiely vznikajú najmä v dôsledku tohto štrukturálneho rozdielu.
Čo je metán?
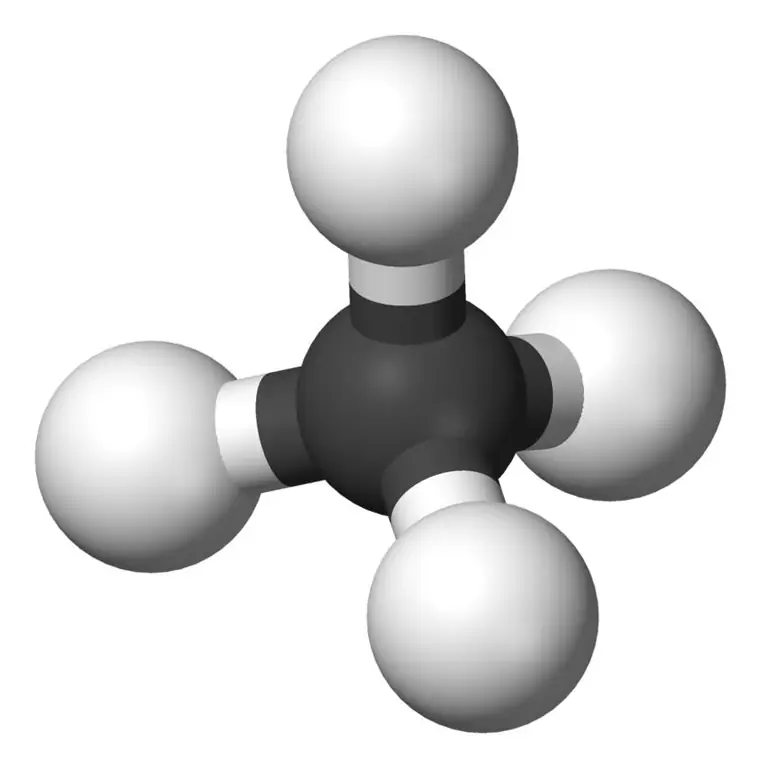
Metán je najmenší člen rodiny alkánov s chemickým vzorcom CH4(štyri atómy vodíka sú viazané na jeden atóm uhlíka). Považuje sa za hlavnú zložku zemného plynu. Metán je bezfarebný plyn bez zápachu a chuti; tiež známy ako karbán, močaristý plyn, zemný plyn, tetrahydrid uhličitý a karbid vodíka. Dá sa ľahko zapáliť a jeho para je ľahšia ako vzduch.
Metán sa prirodzene nachádza pod zemou a pod morským dnom. Atmosférický metán sa považuje za skleníkový plyn. Metán sa s vodou v atmosfére rozkladá na CH3-.
Čo je etán?
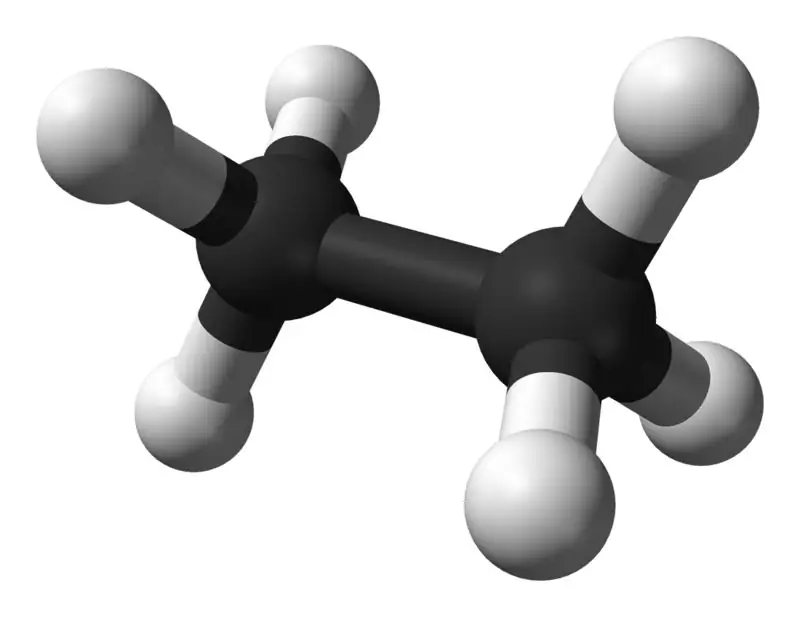
Etán je bezfarebná plynná zlúčenina bez zápachu pri štandardnej teplote a tlaku. Jeho molekulový vzorec a molekulová hmotnosť sú C2H6 a 30,07 g·mol−1 v tomto poradí. Izoluje sa zo zemného plynu ako vedľajší produkt z procesu rafinácie ropy. Etán je veľmi dôležitý pri výrobe etylénu.
Aký je rozdiel medzi metánom a etánom?
Charakteristika metánu a etánu
Štruktúra:
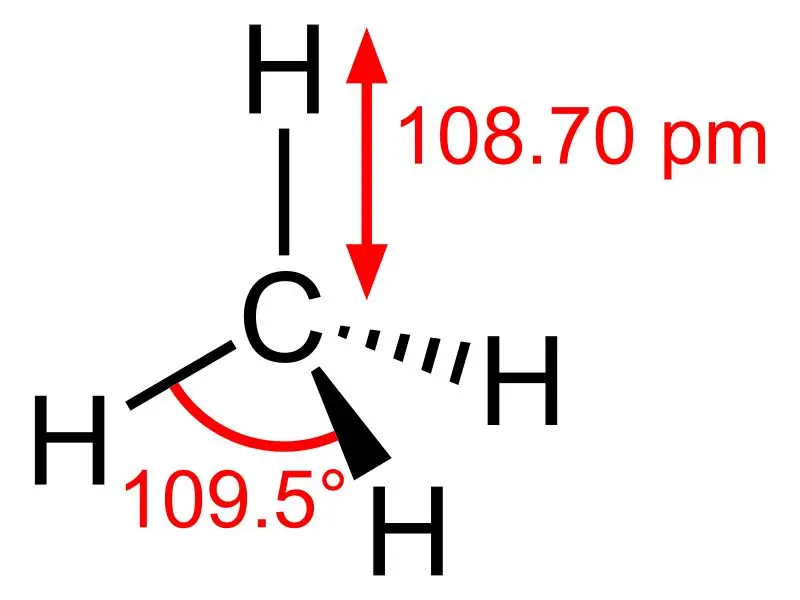
Metán: Molekulový vzorec metánu je CH4, a je to príklad tetraedrickej molekuly so štyrmi ekvivalentnými väzbami C-H (sigma väzbami). Väzbový uhol medzi atómami H-C-H je 109,50 a všetky väzby C-H sú ekvivalentné a rovná sa 108,70 pm.
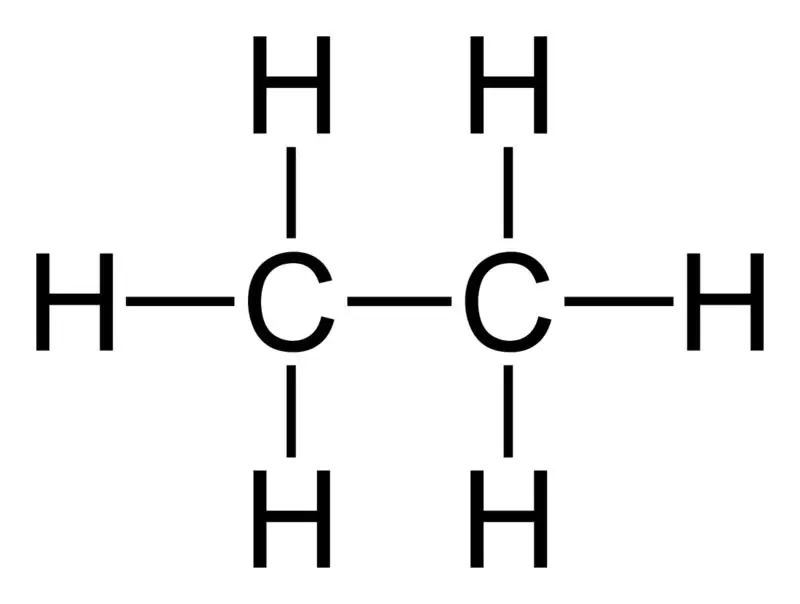
Etán: Molekulový vzorec etánu je C2H6,a ide o nasýtený uhľovodík, pretože neobsahuje viacnásobné väzby.
Chemické vlastnosti:
Metán:
Stabilita: Metán je chemicky veľmi stabilná molekula, ktorá nereaguje s KMnO4, K2Cr 2O7, H2SO4 alebo HNO 3 za normálnych podmienok.
Spaľovanie: V prítomnosti prebytočného vzduchu alebo kyslíka metán horí svetlomodrým nesvietivým plameňom, pričom vzniká oxid uhličitý a voda. Ide o vysoko exotermickú reakciu; preto sa používa ako vynikajúce palivo. V prítomnosti nedostatočného množstva vzduchu alebo kyslíka čiastočne horí na plynný oxid uhoľnatý (CO).
Substitučné reakcie: Metán vykazuje substitučné reakcie s halogénmi. Pri týchto reakciách je jeden alebo viac atómov vodíka nahradených rovnakým počtom atómov halogénu a nazýva sa to „halogenácia.” Reaguje s chlórom (Cl) a brómom (Br) v prítomnosti slnečného žiarenia.
Reakcia s parou: Keď zmes metánu a pary prechádza cez zahriaty (1000 K) nikel nanesený na povrchu oxidu hlinitého, môže produkovať vodík.
Pyrolýza: Keď sa metán zahreje na približne 1300 K, rozloží sa na sadze a vodík.
Etán:
Reakcie: Etánový plyn (CH3CH3) reaguje s parami brómu v prítomnosti svetla za vzniku brómetánu (CH 3CH2Br) a bromovodík (HBr). Je to substitučná reakcia; atóm vodíka v etáne je nahradený atómom brómu.
CH3CH3 + Br2 à CH3 CH2Br + HBr
Spaľovanie: Úplné spaľovanie etánu produkuje 1559,7 kJ/mol (51,9 kJ/g) tepla, oxidu uhličitého a vody.
2 C2H6 + 7 O2 → 4 CO 2 + 6 H2O + 3120 kJ
Môže sa vyskytnúť aj bez nadbytku kyslíka, pričom vzniká zmes amorfného uhlíka a oxidu uhoľnatého.
2 C2H6 + 3 O2 → 4 C + 6 H 2O + energia
2 C2H6 + 5 O2 → 4 CO + 6 H 2O + energia
2 C2H6 + 4 O2 → 2 C + 2 CO + 6 H2O + energia atď.
Definície:
Substitučné reakcie: Substitučná reakcia je chemická reakcia, pri ktorej dochádza k vytesneniu jednej funkčnej skupiny v chemickej zlúčenine a jej nahradeniu inou funkčnou skupinou.
Použitie:
Metán: Metán sa používa v mnohých priemyselných chemických procesoch (ako palivo, zemný plyn, skvapalnený zemný plyn) a prepravuje sa ako chladená kvapalina.
Etán: Etán sa používa ako palivo pre motory a ako chladivo pre extrémne nízkoteplotné systémy. Dodáva sa v oceľových fľašiach ako skvapalnený plyn pod vlastným tlakom pár.






