- Autor Alex Aldridge [email protected].
- Public 2023-12-17 13:49.
- Naposledy zmenené 2025-06-01 07:37.
Kľúčový rozdiel - silný a slabý ligand
Ligand je atóm, ión alebo molekula, ktorá daruje alebo zdieľa dva svoje elektróny prostredníctvom koordinačnej kovalentnej väzby s centrálnym atómom alebo iónom. Koncept ligandov je diskutovaný v rámci koordinačnej chémie. Ligandy sú chemické druhy, ktoré sa podieľajú na tvorbe komplexov s kovovými iónmi. Preto sú tiež známe ako komplexotvorné činidlá. Ligandy môžu byť monodentátne, bidentátne, trojzubé atď. na základe denticity ligandu. Denticita je počet donorových skupín prítomných v ligande. Monodentátny znamená, že ligand má iba jednu donorovú skupinu. Bidentátny znamená, že má dve donorové skupiny na jednu molekulu ligandu. Existujú dva hlavné typy ligandov kategorizovaných na základe teórie kryštálového poľa; silné ligandy (alebo ligandy so silným poľom) a slabé ligandy (alebo ligandy so slabým poľom). Kľúčový rozdiel medzi silnými ligandami a slabými ligandami je v tom, že rozdelenie orbitálov po naviazaní na ligand so silným poľom spôsobuje vyšší rozdiel medzi orbitálmi s vyššou a nižšou energetickou hladinou, zatiaľ čo rozdelenie orbitálov po naviazaní na ligand so slabým poľom spôsobuje nižší rozdiel. medzi orbitálmi vyššej a nižšej energetickej hladiny.
Čo je teória kryštálového poľa?
Teóriu kryštálového poľa možno opísať ako model, ktorý je navrhnutý tak, aby vysvetlil prerušenie degenerácií (elektrónových obalov rovnakej energie) elektrónových orbitálov (zvyčajne d alebo f orbitálov) v dôsledku statického elektrického poľa vytváraného okolitým prostredím. anión alebo anióny (alebo ligandy). Táto teória sa často používa na demonštráciu správania komplexov iónov prechodných kovov. Táto teória môže vysvetliť magnetické vlastnosti, farby koordinačných komplexov, hydratačné entalpie atď.
Teória:
Interakcia medzi kovovým iónom a ligandami je výsledkom príťažlivosti medzi kovovým iónom s kladným nábojom a záporným nábojom nespárovaných elektrónov ligandu. Táto teória je založená hlavne na zmenách vyskytujúcich sa v piatich degenerovaných elektrónových orbitáloch (atóm kovu má päť d orbitálov). Keď sa ligand priblíži ku kovovému iónu, nespárované elektróny sú bližšie k niektorým d orbitálom ako k iným d orbitálom kovového iónu. To spôsobuje stratu degenerácie. A tiež, elektróny v orbitáloch d odpudzujú elektróny ligandu (pretože oba sú negatívne nabité). Orbitály d, ktoré sú bližšie k ligandu, majú teda vysokú energiu ako iné orbitály d. Výsledkom je rozdelenie orbitálov d na orbitály d s vysokou energiou a orbitály d s nízkou energiou na základe energie.
Niektoré faktory ovplyvňujúce toto rozdelenie sú; povaha kovového iónu, oxidačný stav kovového iónu, usporiadanie ligandov okolo centrálneho kovového iónu a povaha ligandov. Po rozdelení týchto orbitálov d na základe energie je rozdiel medzi orbitálmi d s vysokou a nízkou energiou známy ako parameter rozdelenia kryštálového poľa (∆oct pre oktaedrické komplexy).
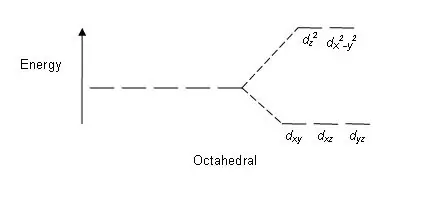
Obrázok 01: Rozdeľovací vzor v oktaedrických komplexoch
Vzor štiepenia: Keďže existuje päť d orbitálov, štiepenie prebieha v pomere 2:3. V oktaedrických komplexoch sú dva orbitály na vysokej energetickej úrovni (spoločne známe ako „napr.“) a tri orbitály sú na nižšej energetickej úrovni (súhrnne známe ako t2g). V tetraedrických komplexoch nastáva opak; tri orbitály sú na vyššej energetickej úrovni a dva na nižšej energetickej úrovni.
Čo je silný ligand?
Silný ligand alebo ligand so silným poľom je ligand, ktorý môže viesť k vyššiemu rozdeleniu kryštálového poľa. To znamená, že väzba ligandu silného poľa spôsobuje vyšší rozdiel medzi orbitálmi s vyššou a nižšou energetickou hladinou. Príklady zahŕňajú CN- (kyanidové ligandy), NO2- (nitroligand) a CO (karbonyl ligandy).
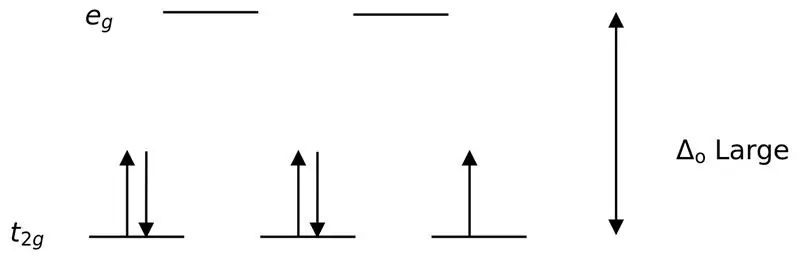
Obrázok 02: Rozdelenie pri nízkej rotácii
Pri tvorbe komplexov s týmito ligandami sa najskôr orbitály s nižšou energiou (t2g) úplne naplnia elektrónmi a až potom sa naplnia do iných orbitálov s vysokou energiou (napr.). Komplexy vytvorené týmto spôsobom sa nazývajú „komplexy s nízkou rotáciou“.
Čo je slabý ligand?
Slabý ligand alebo ligand so slabým poľom je ligand, ktorý môže viesť k nižšiemu rozdeleniu kryštálového poľa. To znamená, že väzba slabého ligandu spôsobuje menší rozdiel medzi orbitálmi s vyššou a nižšou energetickou hladinou.
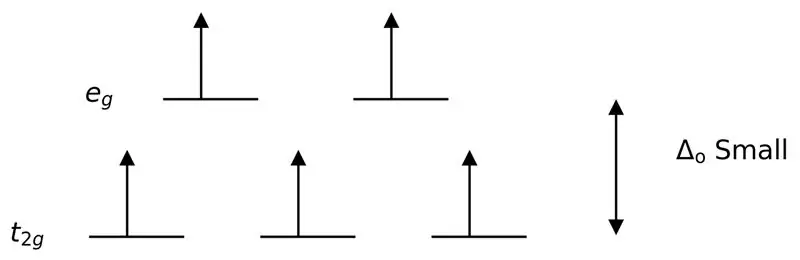
Obrázok 3: Rozdelenie vysokej rotácie
V tomto prípade, keďže nízky rozdiel medzi dvoma orbitálnymi úrovňami spôsobuje odpudzovanie medzi elektrónmi v týchto energetických hladinách, môžu byť orbitály s vyššou energiou ľahko naplnené elektrónmi v porovnaní s orbitálmi s nízkou energiou. Komplexy vytvorené s týmito ligandami sa nazývajú „komplexy s vysokým spinom“. Príklady slabých ligandov zahŕňajú I- (jodidový ligand), Br- (bromidový ligand) atď.
Aký je rozdiel medzi silným a slabým ligandom?
Silný ligand verzus slabý Ligand |
|
| Silný ligand alebo ligand so silným poľom je ligand, ktorý môže viesť k vyššiemu rozdeleniu kryštálového poľa. | Slabý ligand alebo ligand so slabým poľom je ligand, ktorý môže viesť k nižšiemu rozdeleniu kryštálového poľa. |
| Teória | |
| Rozdelenie po naviazaní ligandu silného poľa spôsobuje väčší rozdiel medzi orbitálmi s vyššou a nižšou energetickou hladinou. | Rozdelenie orbitálov po naviazaní ligandu slabého poľa spôsobuje menší rozdiel medzi orbitálmi s vyššou a nižšou energetickou hladinou. |
| Category | |
| Komplexy vytvorené s ligandami so silným poľom sa nazývajú „komplexy s nízkou rotáciou“. | Komplexy vytvorené s ligandami slabého poľa sa nazývajú „komplexy s vysokým spinom“. |
Zhrnutie - Silný ligand verzus slabý Ligand
Silné ligandy a slabé ligandy sú anióny alebo molekuly, ktoré spôsobujú štiepenie d orbitálov kovového iónu na dve energetické úrovne. Rozdiel medzi silnými ligandami a slabými ligandami je v tom, že štiepenie po naviazaní ligandu so silným poľom spôsobuje vyšší rozdiel medzi orbitálmi s vyššou a nižšou energetickou hladinou, zatiaľ čo štiepenie orbitálov po naviazaní slabého ligandu spôsobuje nižší rozdiel medzi vyššou a nižšou energetickou hladinou. orbitaly energetickej hladiny.






